La tabla periódica se basa en la periodicidad química de los elementos ya que los organiza de acuerdo a sus propiedades periódicas (características que varían de manera secuencial por periodos y grupos).
La tabla periódica es un esquema diseñado para organizar y segmentar cada elemento químico, de acuerdo a las propiedades y particularidades que posea. De nombre completo tabla periódica de los elementos, también se la conoce como sistema periódico.
Se trata de una herramienta fundamental para el estudio de la química ya que permite conocer las semejanzas entre diferentes elementos y comprender qué puede resultar de las diversas uniones de los mismos.
 Temas
Temas Resumen
ResumenOrigen de la tabla periódica
Según se advierte al investigar sobre la tabla periódica, la historia de esta estructura está relacionada al descubrimiento de los diferentes elementos químicos y a la necesidad de ordenarlos de alguna manera.
Desde los comienzos de la ciencia se intenta comprender el por qué y el cómo de la materia y los elementos que conforman nuestro sistema. Gracias a las diferentes experiencias de los científicos cada vez se ha podido descomponer aún más la materia para analizarla palmo a palmo, llegando finalmente a averiguar que es mucho más compleja que lo que a simple vista parece.
A partir del siglo XIX los científicos tuvieron la necesidad de establecer un orden en los elementos descubiertos. La forma en la que decidieron hacerlo fue partiendo de su masa atómica y agrupando aquellos que se asemejaran; sin embargo esta tarea no era tan sencilla debido a que resultaba difícil reflejar en un cuadro ordenado las similitudes y diferencias entre unos y otros.
Los aportes de Döbereiner, Chancourtois, Newlands y Meyer
El químico Johann Wolfgang Döbereiner fue quien en 1817 presentó un informe donde se plasmaba la relación que existía entre la masa y las propiedades de los diferentes elementos. Así formó los grupos de elementos semejantes, como lo son las triadas, entre ellas la que forman el cloro, el bromo y el yodo, donde la masa de uno de ellos se ubica en medio de los otros dos. Partiendo de esa investigación, en 1850, se llegaron a armar alrededor de 20 triadas.
Posteriormente, Alexandre-Émile Béguyer de Chancourtois y John Alexander Reina Newlands descubrieron la ley de las octavas, que permitió mejorar no sólo la distribución de los elementos en la tabla, sino las relaciones en ella plasmadas. Dicha ley observa que las propiedades químicas se repiten sucesivamente cada ocho elementos. Sin embargo algunos elementos rompían con ella, por lo que no era suficiente para establecer una coherencia clara en la tabla.
Cuando en 1869 Julius Lothar Meyer comprobó que el volumen atómico de los elementos presentaba una cierta periodicidad, se supo que los elementos tenían un volumen similar a aquellos elementos que se les parecen en composición.

La Unión Internacional de Química Pura y Aplicada (IUPAC, según su sigla en inglés) es el organismo que reconoce oficialmente los elementos químicos que constituyen la tabla periódica.
La tabla periódica de Mendeléyev
En 1869, finalmente, Dimitri Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Más tarde, Mendeléyev añadió las fórmulas correspondientes a los óxidos e hidruros de cada sección. A finales del siglo XIX, la tabla periódica comenzó a incluir el grupo cero (con los denominados gases nobles), llamado de esa forma por la ausencia de actividad química (de valencia cero).
Es necesario reconocer, asimismo, la importancia de John Dalton (1766–1844) en el desarrollo del concepto del atomismo químico, al suponer sobre las posibles combinaciones de los átomos de las sustancias. Dalton eligió a la masa de un átomo de hidrógeno como unidad referencial y creó una estructura basada en masas atómicas relativas.

Cuando dos o más elementos que forman parte de la tabla periódica se combinan químicamente, se obtiene un compuesto químico.
La composición de la materia
La composición de la materia siempre fue motivo de interés para el ser humano. Solía definirse a la materia como la sustancia que constituía a los elementos y luego pasó a asociarse el concepto a la entidad que, al estar presente en el espacio-tiempo, hace que el tensor de tensión-energía de su región sea distinto de cero.
A los constituyentes básicos de la materia se los denomina partículas elementales. El protón, el neutrón y el electrón son ejemplos de estas partículas.
El fragmento más chico de la materia que posee propiedades de un elemento químico es el átomo. Estos átomos, que se unen para formar moléculas, cuentan con un núcleo que está unido a uno o a varios electrones. El modelo atómico de Bohr y el modelo atómico de Rutherford fueron algunas de las propuestas surgidas para explicar la estructura de los átomos.
El núcleo atómico, en este marco, se forma con neutrones y protones que están ligados a través de una fuerza nuclear fuerte. De acuerdo a la cantidad de protones que hay en este núcleo se define el número atómico y se produce la determinación del elemento químico en cuestión.
Es interesante mencionar que los átomos de un elemento pueden presentar masas distintas y diferente cantidad de neutrones en el núcleo. En esos casos, se habla de isótopos.
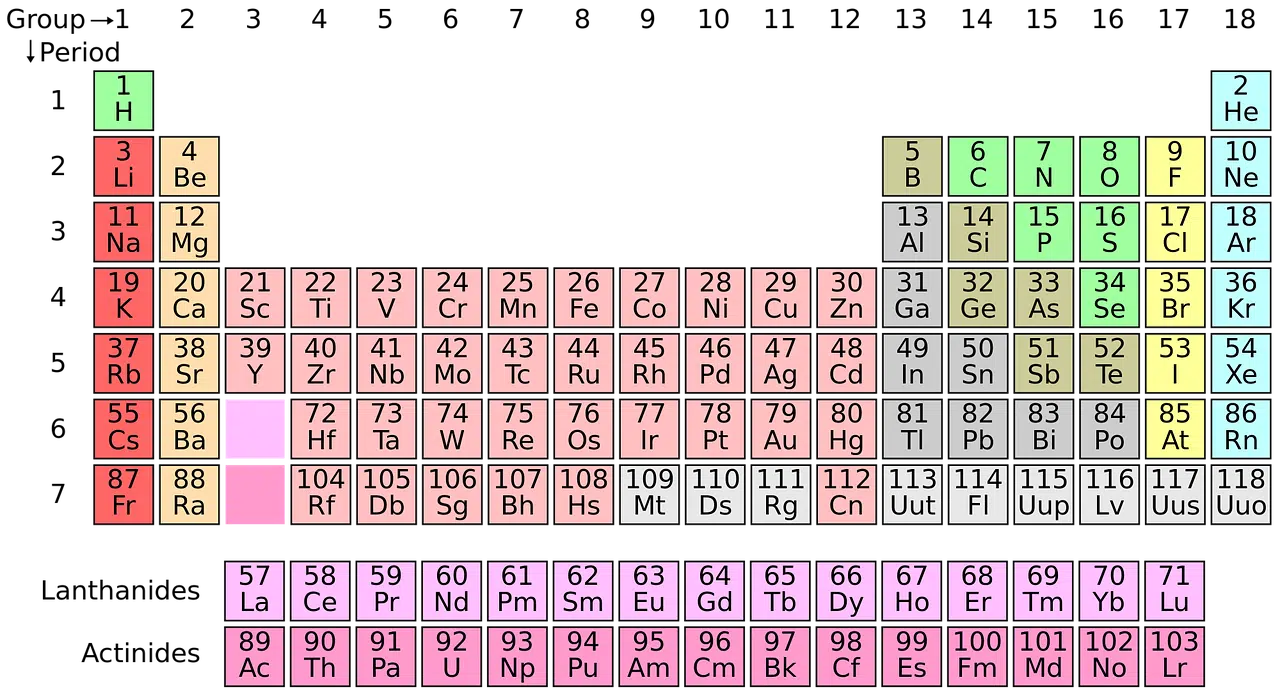
La tabla periódica lo que hace es organizar y reunir los distintos elementos químicos según el número atómico. También considera la configuración electrónica (cómo los electrones se disponen en el átomo) y las propiedades químicas.
La estructura de la tabla periódica
La estructura de la tabla periódica contempla grupos y periodos. Los elementos, de este modo, se organizan en columnas verticales (los grupos, que también pueden mencionarse como familias) y en filas horizontales (los periodos).
El orden implica que los elementos se ubican de izquierda a derecha y de arriba hacia abajo en forma creciente según el número atómico. A medida que se avanza hacia arriba y a la derecha, crecen la electronegatividad, la afinidad electrónica y la ionización; hacia abajo y a la izquierda, en tanto se incrementan el radio iónico y el radio atómico.
Otra división posible se realiza en bloques, según cómo se completan las capas de electrones. La denominación de los bloques obedece al orbital atómico en el cual se ubica el último electrón.

