
La destilación permite separar los componentes de una mezcla.
Destilación es el proceso y el resultado de destilar. Este verbo refiere a filtrar o a hacer que gotee un líquido, o a lograr la separación de un componente respecto a otros a través de la aplicación de calor.
Por ejemplo: «La destilación del whisky comenzó a desarrollarse a finales del siglo XV», «En el proceso de obtención de combustible, la destilación del petróleo es muy importante», «La profesora de Química nos enseñó en qué consiste la destilación».
 Temas
TemasCaracterísticas de la destilación
La noción de destilación -con origen en el vocablo latino destillatio- suele utilizarse para nombrar al procedimiento que permite separar sustancias que forman una mezcla, a través de su condensación o de su vaporización.
Gracias a los diferentes puntos de condensación y ebullición de las sustancias, la destilación posibilita distinguir entre gases licuados, sólidos que estaban disueltos y líquidos.
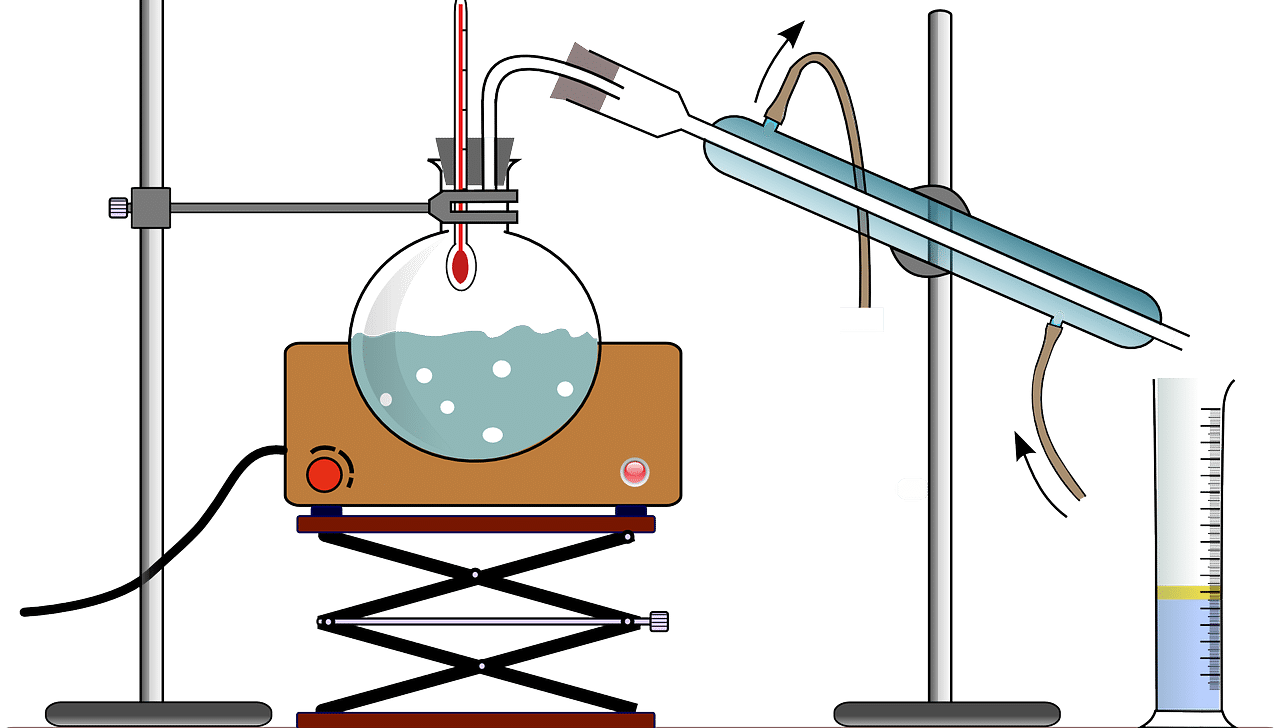
Existen distintos tipos de destilación.
Clasificación según el tipo
De acuerdo a cómo se desarrolla el proceso, es posible hablar de distintos tipos de destilación:
Destilación simple
Se usa cuando existe solamente una sustancia volátil en la mezcla de productos líquidos, o bien cuando hay más de una pero la diferencia del punto de ebullición del líquido de mayor volatilidad con el del resto iguala o supera los 80 °C. Este procedimiento da como resultado un solo producto, ya que: es la cantidad de componentes que había en la mezcla original; uno de los componentes era considerablemente más volátil que el resto. Para efectuar la destilación simple se debe contar con un adaptador de vacío y con un sistema de vacío.
Dentro de este tipo de destilación, podemos distinguir entre las siguientes dos clases:
- A presión atmosférica: se efectúa a presión ambiental. Sirve principalmente en casos en los cuales la temperatura de ebullición del producto es menor a la de su descomposición química.
- A presión reducida: se consigue a través de la disminución de la presión con el objetivo de que descienda el punto de ebullición del componente que deseamos someter a la destilación. Se suele usar cuando el punto de ebullición del producto es mayor a la temperatura de su descomposición química.
Destilación fraccionada
Se usa cuando los puntos de ebullición de las sustancias volátiles de la mezcla de líquidos tienen una diferencia inferior a los 80 °C. Cuando se calienta la mezcla, el vapor adquiere más riqueza en el elemento de mayor volatilidad, propiedad que es aprovechada para dividir los compuestos líquidos. Este tipo de destilación se caracteriza principalmente por requerir una columna de fraccionamiento. Se puede llevar a cabo a presión reducida o atmosférica, tal y como ocurre con la destilación simple.
Destilación por arrastre de vapor
Se utiliza para purificar o aislar los compuestos cuyo punto de ebullición es muy alto, a través del uso de temperaturas que no superen los 100 °C. Este tipo de destilación resulta muy conveniente para tratar con sustancias que tienen un punto de ebullición muy por encima de los 100 °C y que nunca descomponen más allá de dicha temperatura.
Gracias a la destilación por arrastre de vapor es posible separar sustancias que no resultan solubles en H2O, así como aquellas con una ligera volatilidad de otras no volátiles. Se debe agregar un exceso de agua a la mezcla en la cual se encuentra el producto que desea separarse. Para este procedimiento se utilizan dos matraces (vasos de cristal o vidrio de cuya forma suele ser esférica y terminar en un cilindro recto y estrecho): el de destilación, en el cual quedan los compuestos solubles en agua caliente y/o volátiles; y el colector, que recupera los insolubles en agua y los volátiles. Para aislar los compuestos orgánicos del matraz colector se efectúa una extracción.

