El primer paso que vamos a dar en pro de conocer el significado del término orbital molecular es descubrir el origen etimológico de las dos palabras que le dan forma:
-Orbital, en primer lugar, deriva del latín. Más en concreto podemos exponer que es el resultado de la suma de dos componentes léxicos: el vocablo «orbita», que puede traducirse como «trayectoria de movimiento circular», y el sufijo «-al».
-Molecular, en segundo lugar, también procede del latín. En su caso, emana de «molecularis», que es equivalente a «relativo a la cantidad mínima de una sustancia». Ese vocablo latino se formó uniendo tres componentes léxicos: el sustantivo «moles», que significa «masa»; el sufijo «-culum», que se usa para indicar un diminutivo, y el sufijo «-ar», que es equivalente a «relativo a».
Para comprender la idea de orbital molecular, primero es necesario definir otros términos que son indispensables para el entendimiento de la noción. Como punto de partida hay que tener en claro que un átomo es una partícula que no puede ser dividida mediante un método químico.
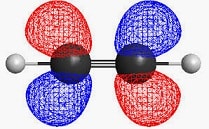 Los átomos exhiben un núcleo que está rodeado de electrones: es decir, de partículas elementales que disponen de carga eléctrica negativa. Los electrones, por lo tanto, giran alrededor del núcleo atómico con movimientos ondulatorios.
Los átomos exhiben un núcleo que está rodeado de electrones: es decir, de partículas elementales que disponen de carga eléctrica negativa. Los electrones, por lo tanto, giran alrededor del núcleo atómico con movimientos ondulatorios.
Se llama orbital atómico a la zona que rodea al núcleo donde se registra una alta probabilidad de hallar un electrón. Se trata, pues, de un espacio en torno al núcleo en el cual es muy probable encontrar electrones.
Ahora sí, podemos centrarnos en la definición de orbital molecular. Así se denomina a la combinación de los orbitales atómicos de dos átomos que están enlazados.
Un orbital molecular se forma por un conjunto de orbitales atómicos en un átomo de una molécula. La configuración electrónica de cada molécula depende de sus orbitales moleculares.
Suele vincularse los orbitales moleculares a funciones matemáticas que reflejan cómo se comportan los electrones en las moléculas desde la perspectiva de la química cuántica. Las funciones matemáticas permiten describir el comportamiento ondulatorio de los electrones.
Dicho de otro modo, un orbital molecular es una región espacial que presenta la densidad electrónica indicada por funciones matemáticas. Estas funciones, a su vez, se emplean para el cálculo de propiedades físicas y químicas.
Es importante mencionar que los orbitales moleculares pueden ser enlazantes (tienen menos energía que los orbitales atómicos que permiten su creación y están en situación de atracción) o antienlazantes (cuentan con mayor energía que cada orbital atómico y se hallan en estado de repulsión).
Además de todo lo expuesto, no podemos pasar por alto tampoco que los orbitales moleculares tienen la particularidad de que pueden cargarse o llenarse electrones de tres formas diferentes. En concreto, mediante estas:
-Mediante el principio de exclusión de Pauli. En este paso se viene a indicar que los citados orbitales al crearse podrán acoger como máximo a dos electrones.
-Por un claro orden decreciente del nivel de energía. En este caso, hay que establecer que se cargarán de electrones antes los orbitales moleculares enlazantes que los antienlazantes.
-A través de la regla de máxima duplicidad de Hund. Esta es la opción que se toma cuando lo que se persigue es obtener orbitales que responden al nombre de semillenos.

