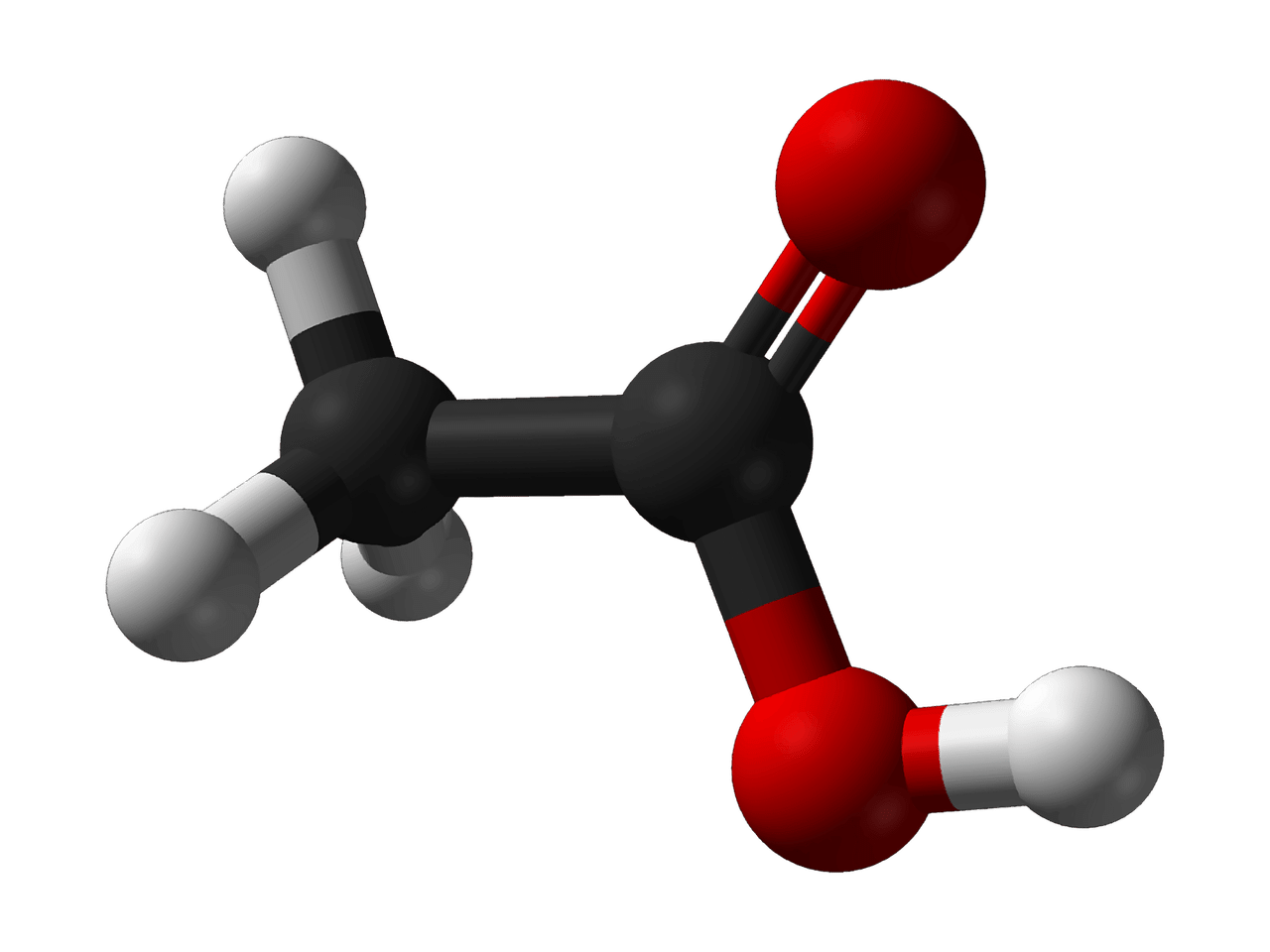
Al ácido acético se lo denomina ácido etanoico de acuerdo a la IUPAC.
El ácido acético es un compuesto químico formado por carbono, hidrógeno y oxígeno. Se trata de una sustancia orgánica que también recibe el nombre de ácido etanoico o ácido metilcarboxílico.
Este líquido que carece de color y se caracteriza por su olor penetrante se genera cuando el alcohol etílico o etanol se oxida. Puede obtenerse por medio de la fermentación o a través de una síntesis química.
 Temas
Temas Resumen
ResumenCaracterísticas del ácido acético
Como todos los compuestos orgánicos, el ácido acético tiene al carbono entre sus constituyentes. Cada una de sus moléculas presenta dos átomos de carbono, además de cuatro átomos de hidrógeno y dos átomos de oxígeno, con lo cual su fórmula molecular es C2H4O2.
El ácido acético es un ácido carboxílico ya que tiene un grupo funcional denominado grupo carboxi o grupo carboxilo (-COOH). En el caso específico de esta sustancia, su fórmula semidesarrollada es CH3-COOH. Al contar con una cadena de dos carbonos, se ubica en el segundo lugar entre los ácidos carboxílicos de mayor simpleza, solo por detrás del ácido fórmico que posee un único carbono. La cadena CH3, en tanto, lo posiciona en el grupo de los metilos.
Otra clasificación del ácido acético es como ácido débil. Esto se debe a que, en una solución acuosa, no se encuentra completamente disociado. En esos casos de disolución, puede registrar la pérdida del protón del grupo carboxi, derivando en acetato (su base conjugada). Cabe destacar que, según la teoría de Brønsted-Lowry, un ácido es una sustancia que puede concretar la cesión de protones, mientras que una base es aquella que puede aceptarlos.
Con una acidez moderada que alcanza los 4,8 pKa, el ácido acético tiene un punto de ebullición de 117,9 ºC. Si nos centramos en el punto de fusión, se ubica en 16,6 ºC.
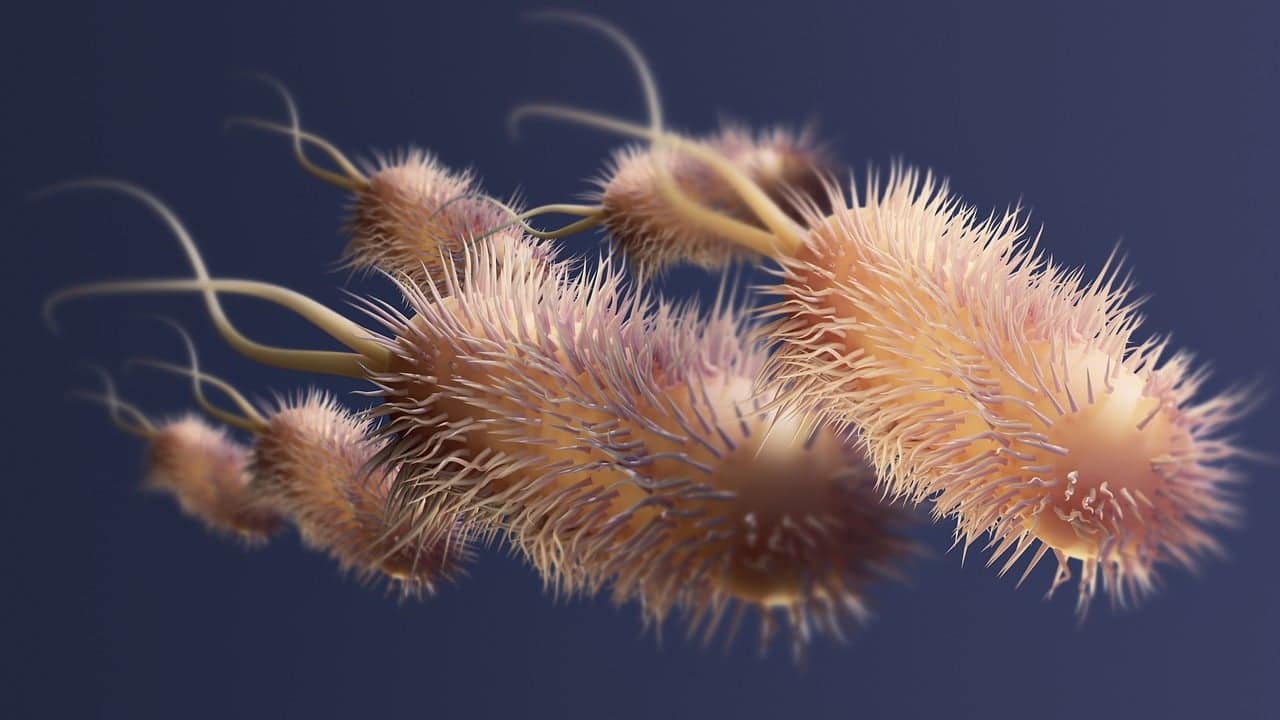
Las bacterias acéticas pueden producir ácido acético.
Métodos de obtención
Los métodos de obtención del ácido acético son varios. La fermentación acética u oxidativa es aquella que producen las bacterias Acetobacter, que son aeróbicas. En este procedimiento, se parte del alcohol etílico.
Lo que hacen estas bacterias es desarrollar la producción de vinagre mediante la fermentación de vino, sidra, papas, arroz o malta, entre otros insumos. Se estima que el vinagre, como condimento, fue creado de manera accidental como consecuencia de fallas en la fermentación al tratar de elaborar vino: cuando el mosto es sometido a una fermentación a alta temperatura, las bacterias de este género actúan sobre la levadura de las uvas.
El ácido acético, por otra parte, también puede obtenerse por fermentación anaeróbica con la intervención de bacterias Clostridium. En este proceso no se emplea el alcohol etílico como intermediario, sino que las bacterias desarrollan una reacción química en azúcares.
A partir de una catálisis, asimismo, es posible producir ácido acético mediante la oxidación del acetaldehído o etanal que lleva a cabo el oxígeno. El acetaldehído, a su vez, se genera por la hidratación del etileno o por la oxidación de la nafta ligera o el butano.
La carbonilación del metanol, finalmente, es el método más habitual para obtener ácido acético. Consiste en propiciar la reacción del monóxido de carbono y el metanol (alcohol metílico), apelando al yoduro de metilo como intermediario y a un catalizador.
Una de las maneras de obtener ácido acético es a partir de una reacción de oxidación del acetaldehído.
Manipulación del ácido acético
La manipulación del ácido acético debe realizarse con precaución. Dependiendo de su concentración, puede acarrear más o menos riesgos.
Debido a su poder de corrosión, puede irritar las mucosas, provocar daños en la vista o quemar la piel. Siempre se lo debe manipular con los guantes apropiados para reducir la probabilidad de padecer un perjuicio.
Ante temperaturas elevadas, el ácido acético se vuelve inflamable. Incluso, al mezclarse con el aire, puede llegar a generar una explosión. Hay que mencionar, por otro lado, que debe almacenarse a distancia del ácido nítrico, el ácido crómico, el ácido perclórico y el etilenglicol porque evidencia una incompatibilidad con dichas sustancias.
Si bien, como vinagre, el ácido acético puede consumirse sin problemas, una solución concentrada puede llegar a resultar letal ya que está en condiciones de modificar el nivel de acidez de la sangre.
Su utilización
La utilización más habitual del ácido acético es como vinagre, un producto en el cual se combina con agua y se emplea como condimento. El vinagre suele usarse con aceite en la preparación de ensaladas, por ejemplo. En algunos casos, se aromatiza con tomillo, romero o estragón, entre otras hierbas.
Asimismo, el vinagre funciona como conservante al lentificar los procesos de putrefacción de los alimentos. Por eso se emplea en encurtidos y escabeches. Otro uso del vinagre aparece en la producción de aderezos, como salsas picantes o kétchup.
La aplicación del vinagre en tareas de limpieza también es frecuente. Ayuda quitar manchas de distintas superficies y a eliminar la cal de cafeteras y otros electrodomésticos.
En el campo de la medicina, el ácido acético se usa como tinte para la detección del virus del papiloma humano. En la histología, sirve para preservar tejidos.
El relevado de fotografías, la fabricación de películas fotográficas o cinematográficas y la producción de celofán y nailon son otros procesos que se desarrollan con ácido acético.


 Publicado por
Publicado por