
La energía de ionización es aquella que se necesita para desprender un electrón en su estado fundamental de un átomo.
La energía de ionización es la cantidad energética mínima que un electrón debe absorber para escapar de la influencia nuclear. El concepto se asocia al nivel de dificultad de un ion o un átomo para ceder un electrón.
Es posible expresar la energía de ionización en kilojulios por mol (kJ/mol) o en electronvoltios. A partir de este dato se puede conocer la reactividad de un compuesto químico y la fuerza de sus enlaces químicos.
 Temas
Temas Resumen
ResumenEntendiendo la energía de ionización
Para entender qué es la energía de ionización, primero hay que conocer el significado de varios términos. Un átomo es una partícula compuesta por electrones que rodean a un núcleo. Estos electrones, a su vez, son partículas elementales que disponen de carga eléctrica negativa.
Un ion, por otro lado, es un átomo o un grupo de átomos que gana carga eléctrica al sumar o perder electrones. En este marco, la idea de ionización refiere a la conversión de átomos o moléculas en iones.
Con todo esto en claro, resulta más sencillo acercarse a la idea de energía de ionización. La noción hace referencia a la energía mínima que se requiere para ionizar un átomo o una molécula.
Lo que permite esta energía (también conocida como potencial de ionización) es que un electrón deje de estar bajo la influencia del núcleo, con lo cual puede desprenderse del átomo o el ion en cuestión.
Debe considerarse que, en su órbita alrededor del núcleo atómico, el electrón presenta una determinada energía. La energía de ionización resulta igual a la diferencia que se registra entre la energía que tiene el electrón en su órbita y la energía que dispone fuera del átomo.
A mayor energía de ionización, más difícil resulta eliminar un electrón.
Clasificación según el tipo
Es posible diferenciar entre distintos tipos de energía de ionización. Se conoce como primera energía de ionización a aquella que se necesita para la eliminación del primer electrón de un átomo calificado como neutro (es decir, con la misma cantidad de electrones y protones). Esta primera energía de ionización resulta idéntica a la energía orbital del electrón, aunque con signo opuesto.
La segunda energía de ionización, por su parte, es la necesaria para eliminar el segundo electrón del ion. Luego van apareciendo otras energías sucesivas (tercera energía de ionización, etc.).
Cabe destacar que resulta más complicado la eliminación del segundo electrón en comparación al primero, lo que implica que la segunda energía de ionización tiene que ser más grande que la primera. Esa tendencia de los niveles de energía se mantiene: la tercera energía de ionización es mayor que la segunda, la cuarta que la tercera y así sucesivamente.
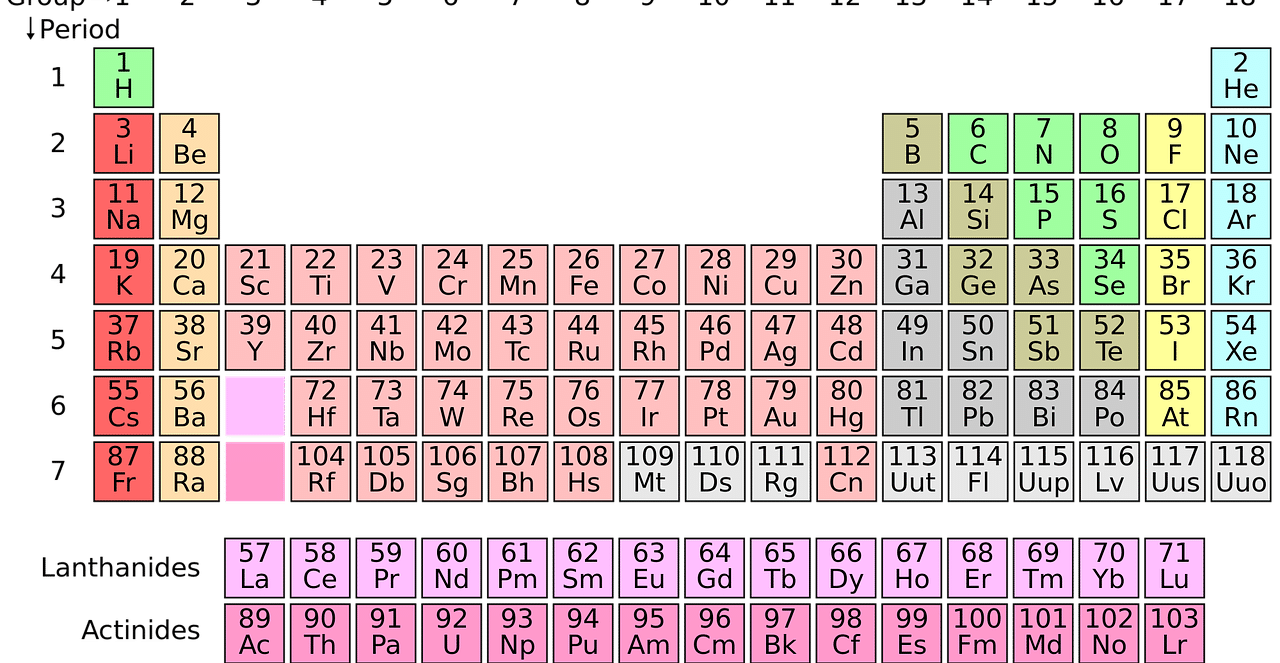
La observación de la tabla periódica permite obtener información acerca de la energía de ionización de los elementos.
Factores que influyen en la energía de ionización
Hay que indicar que, mientras más elevada es la energía de ionización, más complicado es eliminar un electrón. Debe contemplarse, de todos modos, que diversos factores influyen en las fuerzas de atracción.
La distancia del electrón al núcleo es uno de ellos: mientras más cerca esté, más atracción. Por otro lado, si se presentan dos electrones en una misma órbita, la atracción que ejerce el núcleo registra una alteración, siendo menor la energía de ionización en los electrones apareados. También es menor la atracción si existen más electrones entre el núcleo y el nivel exterior.
Por otra parte, las fuerzas de atracción son más fuertes a medida que es más alto el número atómico. Asimismo, la energía de ionización es mayor si la configuración electrónica resulta estable.
La tabla periódica de los elementos
La tabla periódica es un esquema donde cada elemento químico tiene su posición de acuerdo a su número atómico (es decir, a la cantidad de protones que tiene en cada átomo), su configuración electrónica y sus propiedades químicas. De este modo, los elementos que se ubican en una misma columna evidencian un comportamiento parecido.
Como ya indicamos, la energía de ionización crece con el número atómico y registra una disminución para orbitales de mayor energía.
Yendo de izquierda a derecha en la tabla periódica, la energía de ionización va creciendo mientras el radio atómico disminuye. En cambio, un desplazamiento de arriba hacia abajo en la tabla, muestra que la energía de ionización cae porque la cantidad de capas en los elementos aumenta progresivamente.
Las tendencias se explican en que, en la zona inferior de la tabla periódica, los elementos presentan un número más alto de orbitales, con lo cual los electrones más externos están lejos del núcleo, pueden desprenderse con más facilidad y hay una energía de ionización más baja. Además, en la parte izquierda los elementos disponen de menos protones, lo que implica que los electrones también son más fáciles de perder.
Cómo se mide la energía de ionización
La medición de la energía de ionización suele llevarse a cabo mediante una espectroscopía atómica. La espectroscopía es el análisis de la interacción entre la materia y la radiación electromagnética, que puede incluir la emisión o la absorción de la energía radiante.
En este caso, se toma en cuenta el espectro de radiación de luz que emite colores, pudiéndose establecer con la observación los niveles de energía que se necesitan para que cada electrón se libere de su órbita.


 Publicado por
Publicado por