 El concepto de oxoanión se utiliza en el ámbito de la química. Para comprender a qué alude, es importante tener en cuenta varias nociones.
El concepto de oxoanión se utiliza en el ámbito de la química. Para comprender a qué alude, es importante tener en cuenta varias nociones.
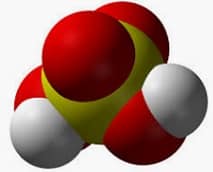
Se llama oxoanión a un ion negativo que proviene de un oxoácido. Cuando un oxoácido pierde hidrógeno, se convierte en un oxoanión.
Cabe recordar que un ion es un átomo o un grupo de átomos que, al ganar o perder uno o más electrones (partículas elementales con carga negativa), obtiene carga eléctrica. En este caso, el ion gana electrones, por lo cual su carga es negativa.
Como todo ion con carga negativa, por otra parte, el oxoanión es un anión. Su átomo central suele ser un no metal, unido a al menos un átomo de oxígeno.
Antes de seguir avanzando, es importante mencionar que un oxoácido es un ácido que tiene oxígeno. Se forma con oxígeno, hidrógeno y, al menos, un elemento más. Al disolverse en agua, el ácido se disocia y cada uno de sus átomos de hidrógeno se separa, cediendo su electrón al resto de la molécula. Así, el oxoácido se transforma en un oxoanión.
Entre los oxoaniones que aparecen con mayor frecuencia podemos mencionar una larga lista. En primer lugar, veamos aquellos que tienen grupos óxido terminales: carbonato, borato, nitrito, nitrato, hiponitrito, silicato, aluminato, fosfito, fosfato, hipofosfito, sulfato, persulfato, sulfito, hiposulfito, clorato, perclorato, clorito, hipoclorito, permanganato, cromato y manganato.
Por otro lado, se encuentran los oxoaniones que, además de grupos óxido terminales, tienen otros de conexión entre un par de átomos de no-metal, y son los siguientes: pirofosfato, dicromato, polioxometalatos (fosfowolframatos, fosfomolibdatos, etcétera).
Un oxoanión simple presenta una fórmula que sigue la llamada regla del octeto. Esto quiere decir que el átomo que no es hidrógeno tiende a establecer enlaces compartiendo, perdiendo o ganando electrones hasta que queda rodeado por ocho electrones de valencia. Más allá de esto, se debe tener en cuenta que hay excepciones a esta regla.
 La regla del octeto la enunció Gilbert Newton Lewis, un importante fisicoquímico norteamericano, en el año 1916. En pocas palabras, define que en el sistema periódico, es decir en la tabla de los elementos químicos, los iones de dichos elementos tienden a terminar sus niveles de energía con un número de electrones igual a ocho, de manera tal que su configuración resulta altamente estable. La estabilidad propia de un elemento que cumpla con la regla del octeto acarrea que no sean muy propensos a reaccionar con otro elemento.
La regla del octeto la enunció Gilbert Newton Lewis, un importante fisicoquímico norteamericano, en el año 1916. En pocas palabras, define que en el sistema periódico, es decir en la tabla de los elementos químicos, los iones de dichos elementos tienden a terminar sus niveles de energía con un número de electrones igual a ocho, de manera tal que su configuración resulta altamente estable. La estabilidad propia de un elemento que cumpla con la regla del octeto acarrea que no sean muy propensos a reaccionar con otro elemento.
Otro nombre por el que se conoce el oxoanión simple es monómero. Los que siguen la regla del octeto suele ser los del segundo período de la tabla, ya que cuentan con orbitales 2s y 2p, que pueden contener hasta ocho electrones. Entre las excepciones se encuentran algunas moléculas cuya cantidad de electrones es impar y, por lo tanto, son altamente reactivas. La inestabilidad de estas moléculas se da porque tienden a formar enlaces con el electrón «que sobra», es decir, con el impar.
Dos oxoaniones simples del segundo período son el ion nitrato y el ion carbonato. Su estructura es de tipo pirámide trigonal, porque cada uno de sus átomos de oxígeno tiene un par de electrones en común con el central, los cuales se ubican a la mayor distancia posible a causa de la repelencia que provocan sus respectivas cargas negativas. Por lo tanto, como hay tres pares de electrones que se comparten entre los átomos, se forman ángulos de 120 grados entre ellos.
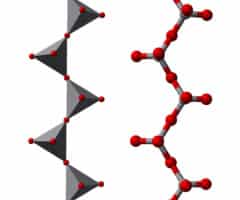
Existen, por otra parte, los oxoaniones condensados. Cuando un oxoanión tiene una carga alta, es posible que experimente una reacción de condensación. Uno de los ejemplos más comunes es la formación del ion dicromato, una reacción en la cual actúa un monómero como base y un condensado como ácido conjugado.

