
Se conoce como sublimación inversa a un proceso termodinámico en el cual se produce un cambio de fase desde el estado gaseoso directamente hacia el estado sólido.
La sublimación inversa es, de acuerdo a expertos en termodinámica, un proceso caracterizado por un cambio de fase experimentado por una sustancia que logra pasar desde el estado gaseoso a la fase sólida salteándose la instancia de estado líquido.
Sublimación regresiva, desublimación y deposición son otras de las denominaciones que recibe este fenómeno que, por sus características, se encuadra en el grupo de los procesos exotérmicos (aquellos que al desarrollarse liberan energía). Antes de hacer hincapié en particularidades y aplicaciones de la sublimación inversa es muy importante diferenciarla bien en relación a la sublimación, donde la transición tampoco implica al estado líquido pero se parte desde un estado sólido y se llega desde ahí a la fase gaseosa.
Cabe destacar que la sublimación inversa puede observarse en toda sustancia pura que esté sometida a condiciones específicas de niveles de presión y de temperatura (las cuales se logran en contextos naturales muy concretos o bien en laboratorios).
 Temas
Temas Resumen
ResumenTermodinámica de la sublimación inversa
Para vincular a la termodinámica con el proceso de sublimación inversa primero es conveniente saber (o recordar) varios conceptos.
Es necesario tener en claro, por ejemplo, que la porción de algo aislada para estudiarla se clasifica como sustancia de trabajo o sistema termodinámico. Si se tiene en cuenta el nivel de aislamiento, es posible reconocer entre sistema aislado, sistema cerrado y sistema abierto. Puede hablarse, incluso, de sistemas heterogéneos y de sistemas homogéneos. En este marco adquiere relevancia la ecuación de estado, un recurso que marca el lazo o conexión entre cuestiones relacionadas a un sistema hidrostático (energía interna, presión, densidad, temperatura y volumen, entre otras variables que sirven para describir el estado de agregación de la materia).
También, para una mejor comprensión de los fenómenos y minimizar las chances de confusiones, hay que posar la mirada en las diferencias que presentan los procesos endotérmicos (en los cuales se advierte un incremento de la magnitud termodinámica conocida como entalpía o bien, la energía interna, notándose en ellos la absorción de energía térmica del entorno) y los procesos exotérmicos (donde la liberación de energía por parte del sistema puede darse en forma de sonido, luz, electricidad o calor).
Y tras mencionar a la entalpía (que equivale a la sumatoria de la energía interna de un cuerpo añadiéndole el producto obtenido del volumen multiplicado por la presión exterior), vale la pena instruirse sobre otra magnitud termodinámica llamada entropía. Esta última sirve para medir la porción de energía que no se utiliza al momento de concretar un trabajo. Es expresada como el cociente surgido del calor que cede un determinado cuerpo y su temperatura absoluta.
No menos trascendentes son las leyes de la termodinámica (Ley de la conservación de la energía, Ley de la Entropía, Principio cero de la termodinámica) ni el calor latente (tal como se nombra a cuánta energía necesita una sustancia específica para lograr un cambio de fase, ya sea de líquido a gaseoso por el proceso de vaporización o de sólido a líquido con un calor vinculado a la fusión.

Del proceso conocido como condensación (cuando una sustancia originalmente en estado gaseoso pasa al estado líquido) surge el calor latente.
Métodos experimentales
Existen varios métodos experimentales para aprender acerca de la sublimación inversa y estudiar detenidamente este proceso.
Una opción válida es la calorimetría destinada a la medición de la cantidad de calor que se transfiere desde, o hacia, una cierta sustancia. De la mano de la espectroscopia (técnica que se basa en la descomposición de la luz y en calcular distintas longitudes de onda, tanto visibles como de luz no visible), por otra parte, se logra establecer el nivel de luz despedido, reflejado o absorbido por un elemento.
Asimismo, son útiles los métodos de la medición de presión de vapor y la microscopia electrónica.
Factores que influyen en la sublimación inversa
Cabe destacar que hay múltiples factores que influyen en la sublimación inversa. La temperatura, la presión y el volumen lideran el listado.
De estar frente a un sistema cerrado expuesto a una cierta temperatura, en tanto, se hace notar una presión, conocida como presión de vapor, ejercida por vapor o fase gaseosa en torno al estado líquido. Esto sucede cada vez que hay un equilibrio dinámico entre el vapor y la fase líquida.
Y no hay que obviar al equilibrio de fases, que implica el contacto de al menos dos estados de la materia (sólido, líquido o gaseoso) y se determina cuando el potencial químico de algún elemento que compone al sistema analizado consigue estabilidad al cabo de un tiempo.
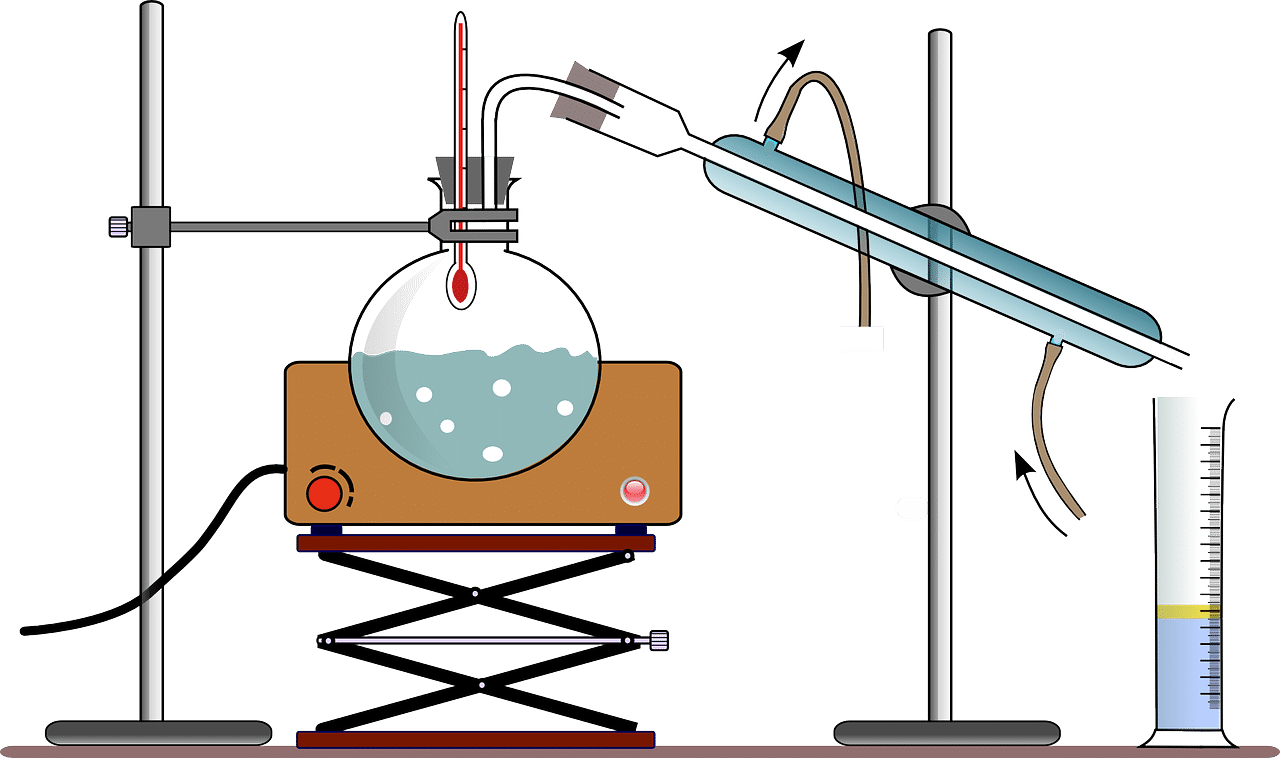
Para estudiar la sublimación inversa hay varias técnicas y métodos para aplicar en un laboratorio.
Procesos que implican un cambio de fase
Los procesos que implican un cambio de fase son cinco.
Cuando tiene lugar una sublimación queda atrás el estado sólido y se pasa directamente a la fase gaseosa. En una fusión, por describir otra posibilidad, una sustancia transita desde el estado sólido hasta transformarse en líquida.
Cambiar de líquido a estado gaseoso una sustancia se consigue con vaporización, mientras que la solidificación se caracteriza por generar la evolución de un gas o un líquido hacia el estado sólido.
Antes de dar por concluido este artículo informativo es interesante aludir a la condensación, tal el nombre de un proceso de carácter físico durante el cual una sustancia, acompañada po una temperatura y una presión especial, logra pasar a estado líquido desde una fase inicial gaseosa.


 Publicado por
Publicado por