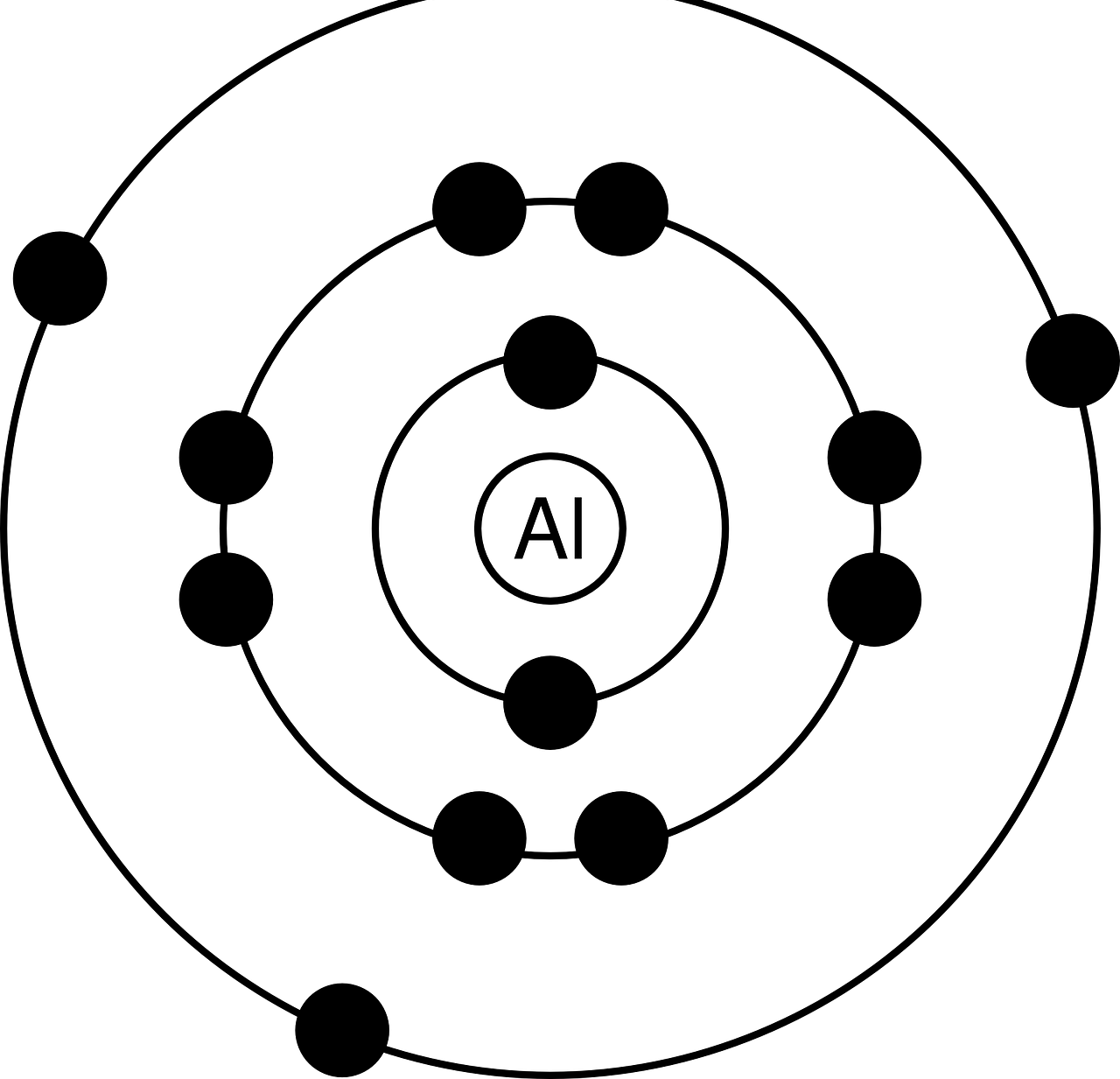
Niels Bohr lanzó un modelo atómico (identificado con su apellido a modo de reconocimiento) en el cual se da cuenta de la existencia de electrones ocupando órbitas estables en torno a un núcleo atómico.
El modelo atómico de Bohr es una presentación centrada en los átomos que realizó en 1913 un destacado físico de origen danés llamado Niels Bohr. Este aporte estuvo motivado por la intención de, tomando al modelo atómico de Rutherford como punto de partida, dar una explicación en relación a cómo la materia consigue estabilidad. Bohr también se ocupó de la cuantización y trató de dar respuestas vinculadas tanto al espectro de emisión como al espectro de absorción observados al analizar gases.
El resultado fue una propuesta que alude a la órbita estable que, en torno al núcleo atómico, puede llegar a tener un electrón, además de no pasar por alto a los particulares espectros de emisión presentados por los átomos. A la hora de enriquecer y fortalecer al contenido de este modelo, incluso, se tomaron en cuenta cuestiones asociadas al efecto fotoeléctrico que tan bien supieron estudiar y describir científicos como Heinrich Hertz y Albert Einstein, entre otros.
Al trazar su esquema, Bohr planteó que los electrones (tal como se denominan a las partículas subatómicas con carga eléctrica negativa) se disponen, bajo un estilo concéntrico, en órbitas circulares rodeando al núcleo.
 Temas
Temas Resumen
ResumenCaracterísticas del modelo atómico de Bohr
El modelo atómico de Bohr reúne características surgidas de ideas o pensamientos que tuvo Niels al querer esclarecer dudas o mejorar el modelo atómico que, previamente, había salido a la luz de la mano de Ernest Rutherford (físico y químico que, a su vez, partió del modelo atómico de Thomson y llegó a hallazgos y resultados relevantes al concretar el denominado experimento de la lámina de oro).
En principio, hizo una descripción de un átomo correspondiente al hidrógeno en cuyo núcleo había un protón, así como a su alrededor giraba un electrón. El experto interpretó, en este contexto, que los electrones sólo podían moverse en ciertas órbitas en función de los niveles de energía. Así se arribó a la asignación de una cifra que en el ámbito de la mecánica cuántica se define como número cuántico principal. En base a éste, y sospechando que cada uno de los electrones poseía un momento angular cuantizado que solamente podía modificarse en fracciones enteras asociadas a la constante de Planck, Bohr llegó a calcular las distancias correspondientes entre el núcleo y las distintas órbitas presentes en el átomo de hidrógeno.
El modelo de Bohr, al no poder adaptarse por completo a átomos de elementos diferentes al hidrógeno en cuanto a espectros, fue perfeccionado en 1916 por Arnold Sommerfeld (quien apeló a conceptos de la teoría de la relatividad para introducir cambios respecto al modelo de Bohr).

El efecto fotoeléctrico explicado por Albert Einstein se contempló en el desarrollo del modelo atómico de Bohr. Cabe destacar que ambos científicos debatieron y protagonizaron disputas en relación a la mecánica cuántica.
Es necesario señalar, de igual modo, que fueron tres los postulados esenciales que derivaron en el modelo atómico impulsado por Bohr. El primero marca que los electrones no irradian energía al describir una órbita circular alrededor del núcleo atómico. En segundo lugar se indica que sólo se permiten para un electrón órbitas con un momento angular que resulte múltiplo entero de la constante de Planck. Por último, se avanzó sobre una premisa orientada a la capacidad de los electrones de emitir o absorber energía únicamente al dar el salto de una a otra órbita. En este proceso se llega a generar o atraer un fotón, el cual exhibe una energía que surge como diferencia de energía entre los niveles involucrados.
Importancia
El modelo atómico de Bohr es importante porque, además de permitir un conocimiento más profundo en relación al átomo, sirvió para comprender mejor a los electrones.
Aunque se hizo necesario continuar las investigaciones para dar respuesta a estructuras más complejas que la del hidrógeno, sin dudas Niels Bohr abrió un camino de aprendizaje que se fue enriqueciendo con el paso del tiempo y sentó las bases para el modelo atómico que rige en la actualidad. También le dio sustento a la esencia de la mecánica cuántica.
Claro que estas contribuciones han tenido limitaciones (no llegó en su época a proporcionar una explicación relacionada a las órbitas estables, por ejemplo). Por fortuna fueron apareciendo científicos que mejoraron el legado de Niels con hallazgos, conjeturas y experimentos. Así ocurrió con Louis de Broglie, responsable de la idea de la existencia de la dualidad onda-partícula en electrones. Esta hipótesis se confirmó en 1927 cuando Lester Halbert Germer y Clinton Joseph Davisson llevaron a cabo una prueba bautizada como experimento de Davisson-Germer.

Se conoce como nivel de energía a cada distancia en la cual se encuentran los electrones en función de su ubicación respecto al núcleo de un átomo.
No se puede pasar por alto que el planteo atómico de Niels jamás ha perdido relevancia: prueba de ello es que, por indicar otro caso a modo de referencia, le sirvió a Erwin Schrödinger, quien también se valió de la dualidad onda-partícula, para el descubrimiento de la bautizada como ecuación de Schrödinger. Se trata de un postulado de índole no relativista identificada como una ecuación vectorial dentro de la cual no se contemplan la aniquilación partícula-antipartícula ni la creación de pares.


 Publicado por
Publicado por