
Los isótopos son átomos pertenecientes a un mismo elemento que se diferencian entre sí por tener distinto número másico.
Núcleo atómico es la denominación que recibe el corazón de todo átomo. En esa porción central, cuya carga es positiva, está concentrada prácticamente toda la masa atómica.
Neutrones y protones, gracias al efecto de la fuerza nuclear fuerte, conviven unidos en el centro del átomo, siendo los constituyentes de aquello que en física nuclear se identifica como nucleón.
¿Cómo se descubrió su existencia? A partir del llamado experimento de Rutherford, contexto en el cual se procedió a bombardear, con partículas alfa (núcleos ionizados de helio que, por lo general, surgen en el marco de una desintegración radioactiva o una reacción nuclear), una delgada lámina de oro. Si bien ciertas partículas llegaban a traspasar, en otras se evidenciaba un rebote en múltiples direcciones. Este escenario llevó a proponer la idea de un átomo constituido mayormente por vacío concentrando el total de su carga (positiva, de acuerdo a una suposición de Ernest Rutherford que se confirmó con el tiempo) y casi el total de su masa en la médula de un volumen muy diminuto bordeado por un grupo de electrones.
 Temas
Temas Resumen
ResumenModelos de núcleo atómico
A lo largo de la Historia se han propuesto distintos modelos de núcleo atómico. El primero que planteó un esquema estructural del interior del átomo fue Joseph John Thompson. Este científico de origen británico presentó al átomo como una estructura esférica de naturaleza compacta y carga positiva donde en diferentes puntos hay electrones (cuya carga es negativa), llegando a conseguirse así neutralidad de carga en la materia.
Cabe resaltar que, antes que él, John Dalton había hecho conjeturas y estudios en torno a cómo se compone la materia, creyendo que había en ella átomos de carácter invisible e indivisible. Consiguió deducir pesos atómicos, aunque desconocía que en el interior del átomo había fragmentos más pequeños.
Recién en 1911, de la mano de un equipo liderado por el físico de nacionalidad neozelandesa Ernest Rutherford e integrado por Ernest Marsden y Hans Geiger, cobró relevancia el núcleo atómico como noción.
Temporadas después, adquirió notoriedad el modelo de Bohr. Desde la perspectiva del físico danés Niels Bohr, los electrones, repartidos en órbitas circulares que dan cuenta de la presencia de múltiples niveles de energía, se mueven a gran velocidad en torno al núcleo atómico. En este postulado se combinaron aspectos tanto del modelo de gota líquida como del modelo de capas.
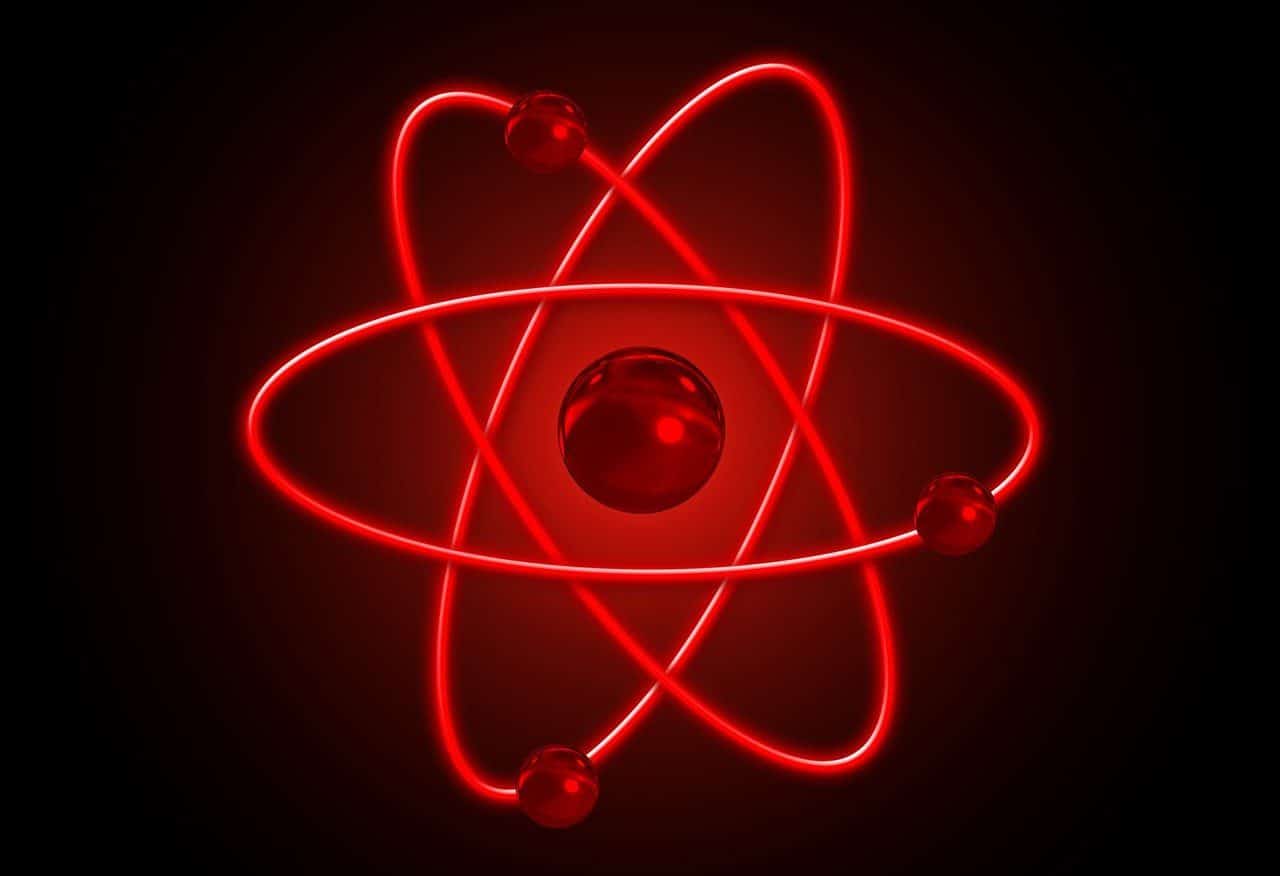
Los neutrones y protones se mantienen enlazados en el núcleo atómico gracias a la interacción nuclear fuerte.
Conceptos asociados
Hay conceptos asociados al estudio y la apreciación del núcleo atómico que conviene investigar para facilitar la comprensión sobre esta temática y ampliar los propios saberes acerca del átomo.
Así sucede, por ejemplo, con el número atómico. Esta noción presente en los ámbitos de la química y la física ha sido bautizada, de igual modo, como número de carga nuclear. Se conecta con los elementos químicos ya que indica la cantidad completa de protones que posee cada átomo que conforma a cada uno de los elementos químicos distribuidos en la tabla periódica.
Los expertos en química, por su parte, hacen referencia al número de masa (o número másico) al referir a la sumatoria de neutrones y protones, llegando a casi duplicar al número atómico.
También es enriquecedor tener en cuenta que los orbitales atómicos son áreas situadas en torno a los núcleos de los átomos en las cuales, por lo general, aparecen electrones.
Y de querer entender qué y cómo es la configuración electrónica, imprescindible para averiguar cómo es la estructura y la organización de los electrones en un átomo (con estos datos queda al descubierto qué posición o ubicación tiene un elemento en la tabla periódica), primero hay que informarse sobre el modelo de capas electrónicas. Es interesante saber al respecto que la capa de electrones (o capa electrónica) indica cómo se distribuye un orbital, sin ignorar que cada una admite una cantidad máxima de electrones.
Otro concepto útil es el de transición electrónica, un indicador de una modificación en el estado cuántico de los electrones. Este fenómeno puede ocurrir en algún nivel electrónico de un átomo (y se define, pues, como transición electrónica atómica) o en un nivel electrónico de una molécula (transición electrónica molecular).

Las propiedades químicas, la configuración electrónica y el número atómica son determinantes para la distribución de los elementos químicos en la tabla periódica.
Particularidades del núcleo atómico
Es interesante hacer foco en las particularidades del núcleo atómico para poder conocer en detalle sus características.
Quienes los han estudiado en profundidad la estructura del átomo resaltan que, además de tener un tamaño considerablemente inferior respecto a las dimensiones típicas de un átomo, presentan una densidad másica sumamente elevada.
Se indica asimismo que, frente a energías bajas, los núcleos atómicos actúan como partículas subatómicas compuestas. Aquellos que no superan un determinado peso atómico y mantienen un equilibrio entre la cantidad de protones y neutrones, en tanto, sobresalen por su estabilidad. En el caso de núcleos dotados de un excesivo número, ya sea de protones o de neutrones, o que poseen neutrones libres, se registra inestabilidad o radiactividad.


 Publicado por
Publicado por