La electroquímica analiza cómo se genera la electricidad a partir de combinaciones de tipo químico.
La electroquímica es la rama de la fisicoquímica centrada en las leyes que se refieren a la generación de electricidad mediante combinaciones de tipo químico. La fisicoquímica, en tanto, es la ciencia que analiza los vínculos entre las propiedades químicas y las propiedades físicas de una materia.
Una de las finalidades de la electroquímica es conocer las reacciones químicas que se producen en la interfaz de un electrodo y un electrolito. El electrodo es el extremo de un conductor eléctrico que está en contacto con un medio y que permite recibir o transmitir una corriente eléctrica. El electrolito, por su parte, es la sustancia sometida a la electrólisis (es decir, a un proceso de descomposición en iones provocado por la corriente).
 Temas
TemasReacciones redox
Cuando hay transferencia de electrones entre las moléculas que intervienen en una reacción química, se trata de una reacción de reducción–oxidación (reacción redox). Estas reacciones son claves para la producción de electricidad.
La transferencia que se genera en la reacción redox se da entre elementos oxidantes y elementos reductores. En este marco se libera energía que se transforma en electricidad.
Historia de la electroquímica
La historia de la electroquímica se remonta a los descubrimientos y avances en el estudio de la electricidad y los procesos químicos. A finales del siglo XVIII, los científicos comenzaron a explorar la relación entre la electricidad y los cambios químicos. Uno de los primeros hitos importantes fue el descubrimiento de la pila voltaica por Alessandro Volta en 1800. La pila voltaica fue el primer dispositivo capaz de generar una corriente eléctrica constante mediante la reacción química entre metales y sustancias líquidas conductivas.
En la década de 1830, Michael Faraday realizó numerosos experimentos y formuló las leyes fundamentales de la electroquímica. Faraday estableció la relación cuantitativa entre la cantidad de electricidad que pasa a través de una solución electrolítica y las reacciones químicas que ocurren en los electrodos. Sus contribuciones sentaron las bases para la comprensión de la electrólisis y el desarrollo de las celdas electroquímicas.
En el siglo XIX, la electroquímica encontró aplicaciones prácticas en la industria y la tecnología. La galvanización, el proceso de recubrir objetos metálicos con una capa protectora, se convirtió en una técnica común. Además, la obtención de aluminio mediante el proceso de electrólisis del óxido de aluminio permitió su producción a gran escala.
A medida que avanzaba el siglo XX, la electroquímica se extendió a campos como la energía y la biología. El desarrollo de las baterías recargables y las celdas de combustible, que aprovechan las reacciones electroquímicas para generar y almacenar energía, revolucionaron la tecnología portátil y los vehículos eléctricos. Además, la electroquímica desempeñó un papel crucial en el avance de la neurociencia y la comprensión de los procesos biológicos que involucran reacciones redox.
En la actualidad, la electroquímica continúa siendo un campo de investigación activo y se aplica en una amplia gama de áreas, incluyendo la fabricación de dispositivos electrónicos, el almacenamiento de energía renovable, la síntesis de productos químicos y la medicina. La comprensión y control de las reacciones electroquímicas son fundamentales para abordar desafíos ambientales y energéticos, y se espera que la electroquímica desempeñe un papel cada vez más importante en el desarrollo de soluciones sostenibles y tecnológicas en el futuro.

Las pilas son una clase de celda electroquímica.
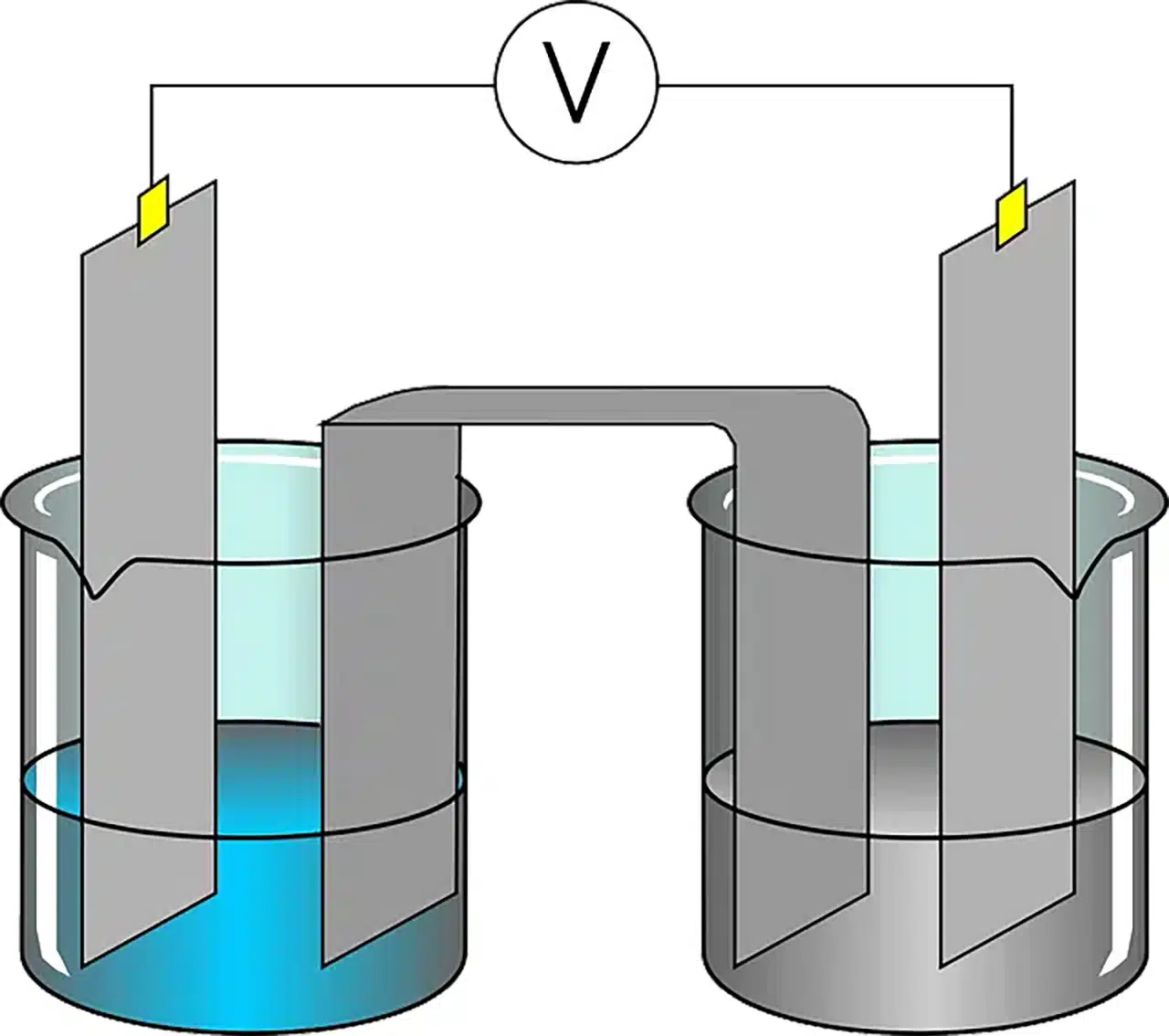
Las celdas electroquímicas
Se llama celda electroquímica al dispositivo que parte de una reacción química para conseguir energía eléctrica o viceversa (cuando con la incorporación de energía eléctrica produce una reacción química). Estas celdas constan de dos electrodos sumergidos en una solución electrolítica que permite el flujo de iones. El electrodo donde ocurre la oxidación se llama ánodo, mientras que el electrodo donde se produce la reducción se denomina cátodo. Durante el funcionamiento de la celda, los electrones son liberados en el ánodo y viajan a través de un circuito externo, generando corriente eléctrica.
Una celda voltaica o celda galvánica, en este contexto, es un tipo de celda electroquímica que adquiere energía eléctrica gracias a las reacciones redox espontáneas que se producen en su interior. Las pilas son celdas voltaicas simples. Las baterías eléctricas, a su vez, se componen de varias celdas voltaicas conectadas en paralelo o en serie.

